Plegamiento
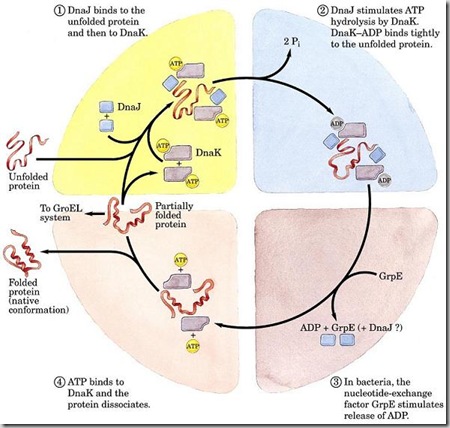
Muchas
proteínas adquieren espontáneamente la correcta conformación tridimensional,
pero otras muchas solo adquieren la conformación correcta con la ayuda de una o
más proteínas chaperonas. Las chaperonas se unen reversiblemente a regiones hidrofóbicas de
las proteínas desplegadas y a los intemediarios de plegamiento; pueden
estabilizar intermediarios, mantener proteínas desplegadas para que pasen con
facilidad a través de membranas, ayudar a desplegar segmentos plegados
incorrectamente, impedir la formación de intermediarios incorrectos o impedir
interacciones inadecuadas con otras proteínas.
Glucosilación
La glucosilación es
la adición de uno o más glúcidos a una proteína lo que da lugar a las glucoproteínas,
que son esenciales en los mecanismos de reconocimiento celular. La glucosilación
puede implicar la adición de unas pocas moléculas glucídicas o de grandes
cadenas ramificadas de oligosacáridos.
Existe un centenar de glucosiltransferasasdistintas,
las enzimas encargadas
de realizar este proceso. El mecanismo es básicamente el mismo en todos los
casos; un azúcar es transferido desde un sustrato dador activado hasta un
aceptor apropiado.

Proteólisis
parcial
La proteólisis parcial
es una etapa frecuente en los procesos de maduración de las proteínas. Pueden
eliminarse secuencias de aminoácidos en ambos extremos o en el interior de la
proteína. La proteólisis en el retículo endoplasmático y en el aparato de
Golgi son, por ejemplo, esenciales en la maduración de la insulina;
la preproinsulina codificada por el ARNm es introducida en el retículo
endoplasmático; una peptidasa la corta y origina la proinsulina que
se pliega para formar los puentes
disulfuro correctamente; la proinsulina es transportada al
aparato de Golgi, donde es empaquetada en gránulos de secreción; entonces se
elimina un fragmento (péptido C) por proteólisis originando la
insulina funcional, que es secretada.

Modificación
de aminoácidos
Sólo
20 aminoácidos están codificados genéticamente y son
incorporados durante la traducción. Sin embargo, las modificaciones
postraducción conducen a la formación de 100 o más derivados de los
aminoácidos. Las modificaciones de los aminoácidos juegan con frecuencia un
papel de gran importancia en la correcta funcionalidad de la proteína.
Son
numerosos los ejemplo de modificación postraducción de aminoácidos. La
formación postraducción de puentes
disulfuro, básicos en la estabilización de la estructura terciariade las proteínas está
catalizada por una disulfuro isomerasa. En
las histonas tiene
lugar la metilación de las lisinas. En el colágeno abunda
el aminoácido 4-hidroxiprolina, que es el resultado de la hidroxilación de
la prolina.
Bibliografía:
Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4


No hay comentarios:
Publicar un comentario